Электрохимическая поляризация. При электролизе происходит химическое превращение в результате протекания электрического тока через электролит. Этот процесс противоположен протекающему в гальванических элементах, производящих работу. При электролизе затрачивается энергия внешнего источника, который обеспечивает прохождение постоянного тока через раствор или расплав. При этом на отрицательном электроде, который принято называть катодом, разряжаются катионы, а на положительном электроде - аноде разряжаются анионы. Прохождение тока вызывает изменение электрического состояния электродов и их потенциалов. Разность между потенциалом электрода, когда через систему протекает постоянный ток, и потенциалом при равновесии и том же электролите называется поляризацией. Таким образом, протекание через электролит более или менее значительного постоянного тока делает систему неравновесной.
Рассмотрим, например, электролиз водного раствора серной кислоты на платиновых электродах. Очевидно, вначале оба электрода были в одинаковом состоянии. В процессе электролиза на электродах происходит выделение водорода и кислорода. Для того, чтобы эти газы достаточно, быстро удалялись с электродов, необходимо чтобы их парциальные давления превышали атмосферное давление. Только при этом условии их удаление будет иметь характер кипения, т.е. газы будут удаляться в виде пузырьков. При парциальных давлениях водорода и кислорода меньше атмосферного их удаление будет иметь диффузионный характер и совершаться медленно.
Для того, чтобы выделяющиеся газы имели давление, равное 1 атм, в соответствии с уравнением,ΔG0 = nE0F необходимо приложить э. д. с., величина которой определяется стандартной энергией Гиббса образования воды, т.е. ΔG0 = -237200 Дж/моль т.е. E = 2372007(2·96493) = 1,23В.
Если приложенная внешняя э. д. с. Eвн < 1,23В, то электролиз практически идти не будет из-за медленности выделения газов. При EВн>1,23В, электролиз идет с достаточной скоростью, что сопровождается накоплением водорода и кислорода вблизи платиновых электродов. Это в свою
262
очередь приведет к тому, что последние начнут функционировать как газовые электроды (вследствие стремления Н2 и O2 к образованию воды). Иными словами, в системе возникает водородно-кислородный гальванический элемент, дающий э. д. с., направленную против Eвн, вызывающей электролиз.
Такое явление, обусловленное выделением продуктов электролиза на электродах и приводящее к возникновению э. д. с., направленной противоположно Евн, называется поляризацией. Если наложенная внешняя э. д.. с. больше 1,23В, то сила тока будет определяться разностью между этой внешней э. д. с. и э. д. с., возникающей вследствие образования водородно-кислородного элемента. Величина Еп носит название э. д. с. поляризации.
Чтобы электролиз осуществлялся в условиях поляризации, E должно превышать падение напряжения в электролите, обусловленное омическим сопротивлением (r) последнего на величину э. д. с. поляризации. В связи с этим сила тока, идущего через электролит, согласно закону Ома, составит
I = (Eвн - Eп)/r.
(Х.1)
Величина Еп становится постоянной после достижения значения 1,23 В, так как рO2 и рH2, не могут превысить атмосферное давление. Поэтому дальнейшее возрастание Eвн приводит к быстрому увеличению силы тока, которая затем становится пропорциональной разности Eвн - Eп, как это видно из рис. Х.1.
Из формулы (Х.1) следует, что в этой области уравнение прямой имеет вид: 1r = Eвн - Eп.
Заметим, что при малых величинах Евн величина I не становится отрицательной, так как вследствие частичной
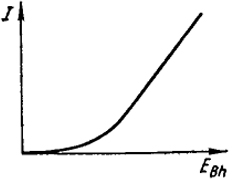
Рис. Х.1. Зависимость силы тока от величины внешней э. д. с. при электролизе
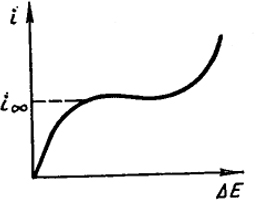
Рис. Х.2. Зависимость между плотностью тока и Δ
E
263
диффузии водорода и кислорода от электродов в объем электролита уменьшается э. д. с. поляризации. Наименьшая величина Евн, при которой начинается длительный электролиз и кривая I - Евн, резко поднимается, называется напряжением разложения Ep.
Казалось бы, что для такого электролиза достаточно, чтобы Eвн лишь немного превышала Eп = 1,23 В. Однако вследствие необратимости процесса электролиза разложение электролита обычно происходит при большей разности потенциалов, чем равновесная э. д. с. гальванического элемента, возникающего вследствие поляризации, и резкий подъем кривой наблюдается при более высоких значениях Eвн. В действительности электролиз раствора серной кислоты происходит при Евн, близкой к 1,7 В. Разность между величинами Еp и Еп называется перенапряжением; в рассматриваемом случае оно составляет 0,47 В.
Ниже приведены значения напряжения разложения водных растворов некоторых электролитов на платиновых электродах:
| Электролит . . |
H2SO4 |
H3PO4 |
HNO3 |
NaOH |
ZnBr2 |
NiSO4 |
| Напряжение разложения, В |
1,67 |
1,70 |
1,69 |
1,67 |
1,80 |
2,09 |
Следует отметить, что при осуществлении электролиза в промышленных масштабах возникновение поляризации на электродах приводит к увеличению расхода электрической энергии. В этом случае поляризация является вредной и для ее уменьшения в электролит добавляют вещества, способные удалять продукты электролиза.
Явления поляризации находят применение при накоплении электрической энергии. Используемые для этого в технике устройства называются аккумуляторами. Их употребление целесообразно при высоком к. п. д., большой энергоемкости, малой массе и компактности. Этим требованиям удовлетворяют только свинцовые (кислотные) и никелевые (щелочные) аккумуляторы, а также разработанные в последнее время особенно энергоемкие цинк-серебряные и никель-кадмиевые. Последние в сочетании с солнечными батареями составляют бортовую энергетику космических кораблей.
Кислотные аккумуляторы приготавливают (заряжают) путем электролиза водного раствора серной кислоты (20- 30 %) между двумя свинцовыми электродами, покрытыми сернокислым свинцом. При этом на катоде осаждается металлический свинец, а на аноде ионы Pb2+ окисляются до
264
Рb4+ и выделяются в виде PBO2. Таким образом, вследствие поляризации образуется гальванический элемент:
Pb ∣ PbSO4, H2SO4 ∣ PbO2, Pb,
в котором при разрядке аккумулятора происходит реакция
Рb + РbO2 + 2H2SO4 = 2PbSO4 + 2Н2О.
Изменение энергии Гиббса при этой реакции составляет ∼384930 Дж и соответственно э. д. с. свинцового аккумулятора близка к 2 В:
- 384930 = - 2E·96493; Е = 384930/(2·96493) = 1,99В.
Левый электрод аккумулятора представляет собой электрод второго рода, а правый - окислительно-восстановительный. При зарядке аккумулятора применяют напряжение ∼2,5 В и доводят раствор электролита до кипения, т.е. разложения воды. Существенно, что при зарядке благодаря большому перенапряжению водорода на свинце электролиз воды при разности потенциалов на электродах, близких к 2 В, не происходит, а идет выделение свинца и окисление Рb2+ до РB4+. Недостатком свинцового аккумулятора является его большая масса. Значительно меньшую массу при такой же емкости имеет никелевый аккумулятор, предложенный Т. Эдиссоном. Он представляет собой цепь
Fe ∣ KOH ∣ Ni2O3·1,2H2O, Ni,
в которой при разрядке происходит реакция
Fe + Ni2O3 1,2H2O + 1,8Н2О = Fe(OH)2 + Ni(OH)2.
Э. д. с. такого аккумулятора составляет 1,34В. В рассмотренных выше примерах поляризация обусловлена химическими изменениями и поэтому называется химической.
Концентрационная поляризация. Пусть два одинаковых серебряных электрода погружены в раствор AgNO3. Очевидно, что разность потенциалов между этими электродами равна нулю. В процессе электролиза на электроды накладывается некоторая разность потенциалов. Вследствие более медленного диффузионного выравнивания концентраций в растворе по сравнению с процессами на электродах вблизи катода (где Ag+ разряжается) концентрация Ag+ будет .несколько меньше, чем в непосредственной близости от анода, где происходит растворение серебра. Таким образом, образуется концентрационный элемент, э. д. с которого направлена против поляризующего тока. Такое явление называется концентрационной поляризацией.
265
Рассмотрим, какими условиями определяется подача ионов серебра к поверхности катода. Как указывалось par нее, на границе металл-раствор существует двойной электрический слой. В простейшем случае он состоит из одного слоя ионов. Вследствие того, что электрод имеет потенциал, обусловленный наложением внешней э. д. с., концентрация Ag+ в двойном слое сп отличается от концентрации в объеме раствора сo. В связи с этим между зоной вблизи электрода и объемом раствора устанавливается перепад концентрации. Таким образом, если при поляризации на электрод наложен отрицательный потенциал, то будет иметь место неравенство сп < сo. Слой, в котором происходит изменение концентрации от сп до сo, называется диффузионным. Как будет показано в гл. XVIII, его толщина δ зависит от условий перемешивания раствора. Например, при использовании пропеллерной мешалки величина δ обратно пропорциональна корню квадратному из числа оборотов мешалки в единицу времени.
Какова будет связь между силой тока и напряжением в условиях концентрационной поляризации? Очевидно, сила тока, идущего через электролит, определится числом ионов Ag+, которые могут диффундировать в единицу времени из объема раствора к электроду. В простейшем случае, когда процесс электролиза становится стационарным, поток ионов П может быть вычислен по уравнению диффузии (см. гл. XIV):
П = -SD(∂c/∂x),
где S - величина поверхности, через которую происходит диффузия; D - коэффициент диффузии; ∂с /∂х - градиент концентрации в направлении оси х, перпендикулярной поверхности электрода.
При стационарном течении процесса градиент концентрации не изменяется во времени и ∂с/∂х = (сo - cп)/δ).
Таким образом, П = SD(сo - сп)/δ.
Так как сила тока I равна произведению числа грамм-ионов, перенесенных в единицу времени, на число Фарадея, то I = FП. Плотность тока i, т.е. сила тока на единицу поверхности электрода составляет.
i = FD(co - cп).δ*
(X.2)
Отсюда видно, что изменение плотности тока может изменить условия поляризации. Из уравнения (Х.2) также следует, что эти условия можно сделать различными для разных электродов путем увеличения или уменьшения их
266
поверхности. При очень большой поляризации, т.е. при большой плотности тока, сп = 0 и
i∞ = FDco/δ.
(X.3)
Плотность тока в таких условиях i∞, называется предельным током диффузии. Почленное деление уравнений (Х.2) и (Х.3) дает выражение
i = i∞[1 - (cп/co)].
(Х.4)
Отсюда можно найти концентрацию ионов серебра у поверхности электрода при данной плотности тока, т.е.
cп = сo[1 - (i/i∞)].
(X.5)
Таким образом, вследствие того, что сп зависит от i, должна также существовать и зависимость между потенциалом электрода и плотностью тока. Потенциал электрода определяется термодинамическим соотношением Е = Е0 - (RT/F)ln cп. Подставляя в его соотношение величину сп из уравнения (Х.5), найдем
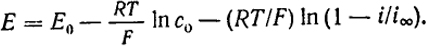 (Х.6)
(Х.6)
Очевидно, при отсутствии поляризации, т.е. в условиях равновесия, когда сп = сo потенциал электрода Eр определяется соотношением
Ep = E0 - (RT/F)lnco.
С учетом этого уравнение (Х.6) можно переписать следующим образом:
E = Ep - (RT/F)ln(1 - i/i∞) или
ΔE = E - Ep = -(RT/F)ln(1 - i/i∞) = -(RT/F)ln
(X.7)
Величина ΔE называется поляризацией электрода. Из уравнения (Х.7) следует, что при малых величинах i значение ΔE близко к нулю. Увеличение плотности тока приводит к уменьшению концентрации у катода, поэтому его потенциал по отношению к раствору возрастает и увеличивается ΔE.
При достижении предельной плотности тока i∞, как уже .отмечалось, сила тока больше увеличиваться не может вследствие невозможности подачи большего числа ионов путем диффузии. Поэтому начиная с этого значения i поляризация должна была бы неограниченно возрастать. В действительности же увеличение потенциала электрода при некотором значении i приводит к возникновению новых электрохимических
267
процессов, например к разряжению ионов водорода, и плотность тока вновь начинает возрастать. Схематически зависимость между i и ΔE показана на рис. Х.2.
Следует подчеркнуть, что полученные соотношения для концентрационной поляризации справедливы лишь для разбавленных растворов, в которых концентрации равны активностям.
Полярография. Явление концентрационной поляризации было использовано чешским академиком Я. Гейровским для создания нового метода анализа, получившего широкое распространение. Этот метод основан на электролизе анализируемых водных растворов в ячейке, катодом которой служит ртутный капельный электрод. Метод основан на том, что предельный ток диффузии при поляризации связан с концентрацией разряжающихся ионов. Действительно, учитывая уравнение (Х.3) и принимая, что в условиях опыта коэффициент диффузии D и толщина диффузионного слоя б постоянны, получим, что
i∞ = αco,
(Х.8)
где α = FD/δ - постоянная величина.
Простейший прибор для полярографического анализа схематически изображен на рис. Х.З.
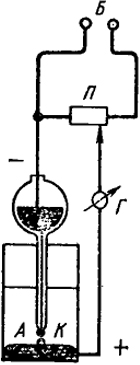
Рис. Х.3. Простейший полярограф
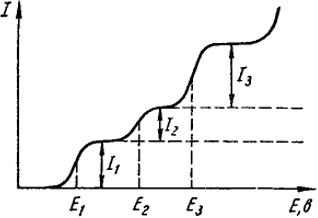
Рис. Х.4. Полярографическая кривая
268
Капилляр K с ртутью погружен в анализируемый раствор. Капля ртути, вытекающая из капилляра в течение того времени, когда она достигает максимального размера и падает, является катодом. После ее падения роль катода играет следующая капля. При помощи потенциометра П, питаемого источником постоянного тока Б, можно задавать различные разности потенциалов между катодом и анодом. Анод представляет собой также ртутный электрод, имеющий большую поверхность (примерно в 100 раз больше, чем у капли).
Задаваемая потенциометром Е должна приводить к изменению потенциалов обоих электродов ЕА и ЕK. Кроме того, при прохождении тока силой I в электролите, имеющем сопротивление r, происходит падение напряжения, равное Ir. Таким образом, Е = ЕK - ЕА + Ir. Вследствие большой поверхности анода он практически не поляризуется. При достаточной концентрации индифферентного электролита в растворе величиной Ir можно пренебречь. Пока поляризующая э. д. с. не достигает значения, при котором происходит в заметной степени разряд катионов, гальванометр Г не показывает наличия тока в цепи. Это объясняется поляризацией на ртутной капле, вследствие которой компенсируется приложенное напряжение. Любой окислительный или восстановительный процесс, например разряд катионов на ртутном капельном электроде, приведет к резкому возрастанию силы тока.
После восстановления катиона данного сорта сила тока будет оставаться постоянной до определенного значения потенциала, при котором начнется выделение другого катиона и сила тока вновь резко возрастет.
Таким образом, при помощи полярографического метода можно проводить анализ раствора одновременно на содержание нескольких катионов.
Как видно из рис. Х.4, полярографическая кривая состоит из нескольких волн. Первая волна относится к наиболее благородному металлу. Каждая волна характеризуется двумя величинами: высотой волны, которая соответствует предельному току диффузии (отрезки I1, I2, I3), и потенциалом полуволны (E1, E2, E3).
Величина потенциала полуволны при восстановлении каждого вида ионов имеет вполне определенное значение. Это позволяет проводить качественный анализ раствора. Высота полярографической волны пропорциональна концентрации восстанавливающегося вещества, поэтому ее измерение служит для количественных определений. Полярографический
269
метод весьма чувствителен и позволяет проводить количественные определения вплоть до концентраций порядка 10-8 моль/л. Применяемые в настоящее время для этой цели приборы - полярографы автоматически увеличивают наложенное напряжение и одновременно записывают силу тока. Получающиеся кривые зависимости силы тока от напряжения называются полярограммами.
270
