Любые химические реакции связаны с перемещением электронов, поэтому могут быть использованы для получения электрического тока. При этом источником электрической энергии является энергия, освобождающаяся при химической реакции. Такое превращение энергии химической реакции в электрическую возможно лишь при помощи специального устройства, называемого гальваническим элементом. Оно позволяет направлять поток электронов по металлическим проводникам.
Простое сжигание водорода сопровождается большим выделением тепла. Если его провести при постоянном объеме, например, в калориметрической бомбе, то ΔU = -284,5 кДж/моль. Если эту же реакцию осуществить в гальваническом элементе электрохимическим путем, то часть этой убыли внутренней энергии может быть использована для получения электрического тока. Схема такого гальванического элемента показана на рис: IX.1.
203
В водный раствор (например, NaOH) погружены два платиновых электрода. Левый электрод омывается пузырьками водорода, а правый - кислородом. Водород в левой части этого гальванического элемента растворяется в платине и ионизируется. Вследствие большого сродства к молекулам воды некоторое количество протонов переходит в слой раствора, непосредственно прилегающий к электроду. При этом образуются ионы гидроксония Н3О+ - они обозначены плюсами в правой части рис. IX. 1, а электроны
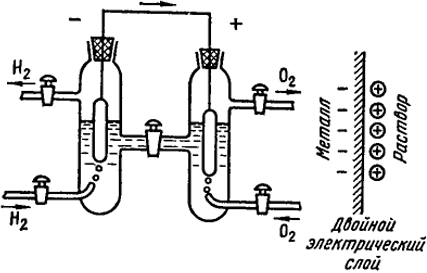
Рис. IX.I. Схема кислородно-водородного гальванического элемента
(минусы) остаются на поверхности платинового электрода. Из-за электростатического притяжения между электронами и ионами гидроксония последние остаются вблизи электрода и не уходят в объем раствора. Благодаря этому на границе металл-раствор возникает так называемый двойной электрический слой, подобный двум обкладкам конденсатора. На поверхности правого электрода происходит реакция образования ионов гидроксила:
3/2O2г + H2Oж + 2e = 2OH-
в результате которой из металла удаляются два электрона. Поверхность металла поэтому заряжается положительно и на ней также образуется двойной электрический слой, но противоположного знака. Если соединить левый и правый электроды металлическим проводником, то по нему потечет электрический ток. Стрелка на рис. IX.1 указывает направление потока электронов. Разность электрических потенциалов на электродах разомкнутого гальванического элемента называется его электродвижущей силой (э. д. с.).
Очевидно поток электронов, возникающий в элементе может быть использован для производства работы, например, для вращения электрического мотора. Протекание тока
204
приводит к уменьшению зарядов двойных электрических слоев. Поэтому ионы Н3О+ и ОН- получают возможность удаляться от электродов и образовывать в растворе нейтральные молекулы воды. Одновременно вследствие реакций на электродах вновь восстанавливаются двойные слои. Происходящие на электродах и в растворе изменения отражаются следующими уравнениями:
H2г = 2H+ + 2e;
3/2 O2г + H2Oж + 2e = 2OH-;
2H+ + 2OH- = 2H2Oж,
сумма которых представляет собой реакцию образования воды:
H2г + 1/2O2г = H2Oж,
Таким образом, одну и ту же реакцию образования воды из элементов можно осуществить двумя различными способами. Какой из этих способов выгоднее с точки зрения превращения энергии химической реакции в работу? В первом способе при сжигании водорода в калориметрической бомбе (V = const) при 298 К уменьшение внутренней энергии равно количеству выделившегося тепла -ΔU = 284,5 кДж/моль, а работа равна нулю.
Во втором случае часть этого изменения внутренней энергии (ΔG) может быть превращена в электрическую работу. Если реакция в гальваническом элементе проводится обратимо, то сопровождающая ее убыль энергии Гиббса полностью идет на производство электрической работы.
В рассматриваемом случае ΔG0 = -237,2 кДж/моль и, следовательно, только ∼47 кДж/моль переходит в тепло. Этот пример показывает, что вообще энергию, освобождающуюся при горении природных видов топлива, выгоднее непосредственно преобразовывать в электрическую, так как к. п. д. тепловых машин и тепловых электростанций невелик. Описанный водородно-кислородный элемент является примером так называемых топливных элементов.
Работы по созданию таких элементов получили в последнее время широкое развитие в связи с новыми задачами техники. В этих элементах топливо и окислитель должны храниться отдельно и подаваться к электродам, на которых осуществляются электрохимические реакции. При этом элемент может работать непрерывно, если к нему подводятся реагенты и отводятся продукты реакции, что особенно удобно при использовании жидких и газообразных веществ.
205
Вместо сжигания угля возможно использовать реакцию Ст + О2г = СО2г для получения электрического тока.
Очевидно, что в реальных условиях гальванические элементы работают необратимо, поэтому в работу превращается лишь часть изменения энергии Гиббса реакции, протекающей в элементе. Повторим, что гальванический элемент может работать при условии протекания в нем самопроизвольной химической реакции или какого-либо другого самопроизвольного процесса, сопровождающегося убылью энергии Гиббса.
Если к рассматриваемому гальваническому элементу приложить извне достаточно большую разность потенциалов, превышающую его э. д. с. и имеющую противоположное направление, то будет происходить разложение воды с выделением водорода и кислорода. Таким образом, процессы получения электрического тока в гальванических элементах и электролиза взаимно противоположны.
Особенностью электрохимического процесса в гальваническом элементе является важная для теории возможность его осуществления в условиях весьма близких к обратимости. Это достигается благодаря потенциометрическому методу, в котором э. д. с. изучаемого гальванического элемента практически полностью компенсируется с помощью противоположно направленной э.д. с. внешнего источника. Такой прием позволяет измерять э.д.с. при отсутствии тока в цепи, т.е. когда элемент не работает, а его э.д.с. максимальна. Контроль за отсутствием тока проводят гальванометрами (нуль-инструментами) высокой чувствительности. Они дают отклонение при прохождении тока силой 10-8 - 10-9 А. Такой слабый ток при прохождении через электролит даже в течение многих лет не смог бы выделить сколько-нибудь заметных количеств вещества.

Рис. IX.2. Схема измерения э.д.с. методом компенсации
Принципиальная схема измерения э. д. с. гальванического элемента компенсационным методом показана на рис. IX.2. Постоянный ток от вспомогательной батареи ВБ подается на концы реохорда АВ - проволоки с постоянным сечением. Поэтому падение напряжения вдоль реохорда пропорционально длине соответствующего отрезка на прямой АВ. С помощью подвижного контакта С можно отбирать произвольную часть падения напряжения между точками
206
А и В. Из рис. IX.2 видно, что напряжение, снимаемое с любого участка реохорда, например АС, направлено навстречу э. д. с. элемента X.
Передвигая контакт С по реохорду, находят такое положение, при котором нуль-гальванометр Г указывает отсутствие тока в цепи АХГС. Это означает, что падение потенциала от ВБ на отрезке АС полностью компенсирует э. д. с. элемента X.
Если э. д. с. вспомогательной батареи ВБ равна ЕБ, то э. д. с. элемента X ЕX определяется из пропорции:
ЕХ/ЕБ = АС/АВ, откуда ЕX = (АС/АВ) ЕБ.
Для того, чтобы откалибровать вспомогательную батарею перед измерениями ЕX, вместо элемента X включают другой, э. д. с. которого точно известна, например стандартный элемент Вестона. Устройство этого элемента будет описано ниже.
Повторим, что определяемая таким образом э. д. с. максимальна, так как при измерении отсутствует падение потенциала как вне, так и внутри элемента. Работа, совершаемая элементом с ничтожно малым током при обратимом проведении процесса была бы максимальной.
Теоретический и практический интерес представляют гальванические элементы с металлическими электродами. Рассмотрим, например, реакцию Znт + CuSО4водн. р-р. = ZnSО4водн. р-р + Cuт или Znт + Cu2+ = Zn+2 + +Cuт, которая может быть осуществлена двумя путями. Один из них является полностью необратимым. Цинковую пластинку помещают в водный раствор медного купороса, при этом происходит выделение металлической меди и растворение цинка. Электроны переходят от цинка непосредственно к меди, и реакция протекает без производства работы, а сопровождается только выделением тепла. В случае водородно-кислородного элемента, можно создать условия, в которых электроны будут двигаться по металлическому проводнику и совершать работу. Это достигается в гальваническом элементе, где цинковый электрод погружен в раствор ZnSO4, а медный электрод в раствор СиSO4.
Растворы отделены друг от друга пористой (керамической) перегородкой, препятствующей их смешению, но обеспечивающей прохождение электрического тока вследствие диффузии ионов через поры. Такой элемент, на электродах которого образуются двойные электрические слои, был сконструирован русским электрохимиком Б.С. Якоби.
Величина и знак электрических зарядов в двойных слоях
207
пределяются работой удаления электрона из металла и энергией гидратации его ионов. В раствор легко будут переходить те металлы, у которых меньше работа выхода электронов и больше энергия гидратации ионов, т.е. менее благородные металлы. Так как цинк менее благороден, чем медь, то он зарядится более отрицательно по сравнению с медью. Если соединить оба электрода металлическим проводником, то электроны будут перемещаться от цинка к меди. Вследствие этого ионы цинка Zn2+ не удерживаются в двойном слое притяжением электронов, переходят в объем раствора, а перешедшие на медный электрод электроны разряжают ионы Cu2+, переводя их в металлическое состояние.
Следовательно, в процессе работы элемента происходит растворение цинкового электрода и осаждение меди на медном электроде. Чтобы элемент работал, цепь должна быть замкнутой, т.е. между растворами должен быть электрический контакт. Перенос тока внутри элемента осуществляется ионами. В элементе переход электронов от цинка к меди происходит не в условиях непосредственного контакта этих металлов, а при помощи проводника. Суммарная реакция в элементе складывается из двух пространственно разделенных электродных процессов.
Реакции, протекающие в гальванических элементах являются окислительно-восстановительными. В рассматриваемом случае окисляется цинк, который теряет электроны, а восстанавливается медь, приобретающая электроны. Вообще любая окислительно-восстановительная реакция может быть использована для получения электрического тока с помощью гальванического элемента. Как упоминалось, такой реакцией может быть горение любого вида топлива.
При схематической записи гальванических элементов границы между фазами отмечаются вертикальными линиями. При условии, что на границе двух жидкостей (в данном случае растворов ZnSO4 и CuSO4) нет разности потенциалов, ее обозначают двумя вертикальными линиями. Схема рассмотренного элемента имеет следующий вид:
Zn ∣ ZnSO4 ∥ CuSO4 ∣ Cu.
Принято записывать подобные схемы таким образом, чтобы левый электрод был отрицательным (электроны текут по металлическому проводнику слева направо и в том же направлении переносится ионами положительное электричество внутри элемента). Такая запись отвечает протеканию
208
реакции, сопровождающейся убылью энергии Гиббса и положительной величине э. д. с.
Гальванические элементы могут быть построены не только с использованием водных растворов электролитов, но и с, применением расплавов. Примером такого элемента может служить цепь Ag ∣ AgBr ∣ Br2, в которой левый электрод серебряный, а правый - представляет собой графит, омываемый газообразным бромом, а электролитом является расплавленное AgBr. На левом электроде растворяется серебро: Agт → Ag+ + e, а на правом - адсорбированный графитом бром: 1/2Br2г + e = Br-. Таким образом, в элементе происходит реакция: Agт + 1/2Br2г = AgBrж.
В последнее время приобрели большое значение гальванические элементы с твердыми электролитами, имеющими кислородную проводимость (см. гл. VIII), например,
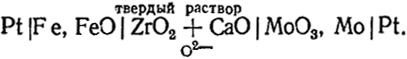
Левый электрод представляет собой смесь железа и его оксида. Здесь происходит реакция окисления железа ионами О2-, приходящими через твердый электролит. При этом освобождаются электроны, и электрод получает отрицательный заряд. На правом электроде, состоящем из смеси Мо и МоО3, происходит восстановление оксида. Это сопровождается поглощением электронов таким образом, что электрод заряжается положительно, а освободившиеся ионы О2 могут мигрировать через электролит к левому электроду. Реакция на электроде изображается следующим уравнением 3Feт + 3О2- = 3FеОт + 6е; на правом электроде: МоО3т + 6е = Мот + 3О2-.
Заметим, что сумма этих двух реакций 3Fет + МоОт = 3FеОт + Мот есть процесс восстановления оксида молибдена железом, самопроизвольное протекание которого является источником электрической энергии производимой элементом.
Из рассмотренных примеров видно, что реакцию, протекающую в гальваническом элементе, можно представить в виде двух отдельных электродных реакций.
Можно предположить, что э. д. с. гальванического элемента должна зависеть от природы реагирующих веществ, их концентраций и температуры. Чтобы найти выражения для этих зависимостей, необходимо рассмотреть термодинамические соотношения, характеризующие работу гальванического элемента.
Пусть в гальваническом элементе протекает реакция:
209
M + Nn+ = Mn+. Работа, производимая элементом при расходе 1 моля М, определяется произведением количества электричества nF на величину э. д. с. Е, т.е. W = nFE, где п - число молей электронов, протекающих через цепь; F - число Фарадея, равное 96493 Кл. Например, для реакции Zn + Cu2+ = Zn2+ + Cu, n = 2. Если элемент работает обратимо при постоянных давлении и температуре, то произведенная им работа равна убыли энергии Гиббса, т.е. ΔG = W:
ΔG = -nFE = -96493E.
(IX.1)
Если элемент работает необратимо, то nFE < -ΔG, т.е. э.д.с. меньше, чем при обратимом проведении реакции. Выражая E в В, получаем величину ΔG в Дж.
Таким образом, если известно стехиометрическое уравнение протекающей в гальваническом элементе реакции и табличные данные об изменении энергии Гиббса, можно рассчитать э. д. с.
Так, для рассмотренного выше водородно-кислородного элемента, работающего за счет энергии, освобождающейся при реакции Н2г + 1/2О2г = Н2Ож, для которой ΔG
= -237200 Дж,
п = 2,
рH2 =
рO2 = 1.
E = -ΔG
/
n·96493 = -(-237200/2)·96493 −
∼ 1,2 В.
Из уравнения IX.1 следует, что измерение э. д. с. гальванического элемента позволяет найти изменение энергии Гиббса протекающей в нем реакции. Поэтому метод э. д. с. широко используется для определения термодинамических свойств веществ.
В приведенном выше примере этот метод позволяет найти ΔG реакции восстановления МоО3 железом. Зная стандартное изменение энергии Гиббса при образовании FеО(ΔG
FeO) по найденному значению Δ
G, можно найти энергию Гиббса образования МоО
3 из уравнения:
ΔG = 3ΔG
FeO - Δ
G
МоО
3
Зависимость э. д. с. от температуры. Поскольку энергия Гиббса есть функция температуры, то и э. д. с. гальванического элемента также должна зависеть от температуры.
Для нахождения этой зависимости воспользуемся уравнением Гиббса-Гельмгольца: ΔG = ΔH + T(∂ΔG/∂T)p подставив в него выражение ΔG через э. д. с. При этом получим -nEF = ΔH - TnF(dE/dT) или
-ΔH = nF[E - Т (dE/dT)],
(IX.2)
210
или
-ΔH = W - TnF(dE/dT).
(IX.3)
Сначала представим себе, что гальванический элемент, помещенный в калориметр, является коротко замкнутым. В этом случае производимая им электрическая энергия полностью превратится в тепло, количество которого равно энтальпии реакции ΔH, и, следовательно, работа будет равна нулю.
Пусть теперь реакция в элементе осуществляется обратимо, например, провода от электродов выведены из калориметра, подведены к мотору, и электрический ток производит работу. Тогда часть освобождающейся при реакции энергии превратиться в электрическую работу W, а другая часть Q останется в виде тепла и будет измерена в калориметре. Согласно первому закону термодинамики
-ΔH = W - Q
(IX.4)
Сопоставление уравнений (IX.3) и (IX.4) показывает, что
Q = TnF(dE/dT).
(IX.5)
Очевидно, чем ближе протекание реакций в гальваническом элементе к условиям обратимости, тем бо́льшая часть ΔG превращается в работу. Величина Q, которая характеризует связанную энергию, определяет количество тепла, неизбежно выделяющегося (или поглощающегося) в том случае, когда элемент работает обратимо. Так как (∂ΔG/∂T)р = -ΔS и (∂ΔG/∂Т)р = -пF(dЕ/dТ), то
ΔS = nF(dE/dT),
(IX.6)
и, следовательно, измерения температурной зависимости э. д. с. позволяют вычислить изменение энтропии при реакции, протекающей в гальваническом элементе. Следует подчеркнуть, что гальванический элемент может работать как с выделением, так и с поглощением тепла. В последнем случае он превращает в работу тепло окружающей среды. Это не находится в противоречии со вторым законом термодинамики, так как процессы в гальванических элементах не являются непрерывными и прекращаются при израсходовании материала электродов.
Знак и величина Q определяют температурную зависимость э. д. с. Если при работе элемента выделяется тепло, т.е. Q < 0, то температурный коэффициент э. д. с. dE/dT < 0. Это наиболее часто встречающийся случай, так как большинство
211
элементов работает с выделением тепла. Наоборот, при Q > 0 э. д. с. растет с температурой.
Для гальванических элементов, служащих в качестве эталонов, при электрических измерениях подбирают такие реакции, в которых Q весьма мало и dЕ/dТ близко к нулю. Так, зависимость э. д. с. от температуры широко используемого стандартного элемента Вестона выражается уравнением:
E = 1,0183 - 0,0000406 (t - 20) В.
Он составлен по схеме: Cd ∣ CdSO4 ∣ ∣ Hg2SO4 ∣ Hg, и в нем протекает реакция Cdт + 2Hg+ = Cd2+ + 2Hgж1.
В качестве примера применения уравнений (IX.4) и (IX.5) вычислим величину dE/dT для элемента, в котором протекает реакция Znт + 2AgCl = ZnCl2 + 2Agт
-ΔH = 217760 Дж, а E = 1,015 В при 0° C. Отсюда
-Q = -ΔH = 217760 - 2·96493·1,015 = 21880 Дж.
dE/dT = -218807(273·2·96493) −∼ - 4·10-4 В/К.
Примером элемента с положительным температурным коэффициентом является ячейка Hg ∣ Hg2Cl2, KCl ∣ KOH ∣ Hg2O ∣ Hg, в которой протекает реакция Hg2Cl2 + 2KOH = 2KCl + Hg2O + H2O.
Левый электрод этого элемента называемый каломельным, часто используется в электрохимических измерениях. Он состоит из жидкой ртути, находящейся в контакте с твердой каломелью Hg2Cl2 и водным раствором какого-либо сильного электролита, например KС1. Реакция, идущая в рассматриваемом элементе, является эндотермической, ΔH = 13720 Дж, а W = 31570 Дж. Таким образом Q = 13720 + 31570 = 45240 Дж, т.е. элемент поглощает из окружающей среды тепло, равное 45240 Дж. Часть этого тепла, равная 31570 Дж, идет на производство работы.
Зависимость э. д. с. от концентраций электролитов, участвующих в реакции, может быть: найдена при помощи уравнения изотермы химической реакции.
Пусть в гальваническом элементе протекает реакция A + B = 2D, при этом ΔG = RTlnK + RTln (c
/
cAcB). Подставляя вместо Δ
G величину -
nEF и разделив обе части уравнения на -
пF, получим
E =
RTln(
K/nF) - [
RT/nFln (
c
/
cAcB)]. или, обозначая величину
RTln
K/
nF, зависящую только от температуры, через
E0, будем иметь:
E = E0 - (RT/nF[ln(c
/ cAcB)].
(IX.7.)
212
Величина E0 называется стандартной э. д. с. элемента. Она характеризует элемент, в котором концентрации всех участвующих в реакции веществ равны единице, а изменение энергии Гиббса равно стандартному ΔG0. Заменив в уравнении (IX.7) натуральный логарифм десятичным, получим для температуры 25 °C.
 (IX.8)
(IX.8)
Очевидно, что для электролитов нельзя просто пользоваться аналитическими концентрациями соответствующих веществ, а необходимо учитывать диссоциацию и взаимодействие ионов. В связи с этим возникает задача определения активности электролитов.
213
1
Обычно применяют насыщенный раствор CdS0
4.
