В простейших случаях процент ионных состояний может быть определен квантово-химическим расчетом. Для этого коэффициент k в уравнении собственной функции молекулы ψ = ψатом + kψион выбирается таким образом, чтобы энергия имела минимальное значение. В симметричных молекулах типа A2 ионное состояние играет небольшую роль. Так, учет ионных состояний в молекуле водорода приводит к увеличению энергии связи лишь на 5 %.
Однако в несимметричной молекуле типа АВ при различной электроотрицательности атомов ионная связь может играть сравнимую с гомеополярной роль (например, у HF) или даже основную роль (молекулы типа NaF).
Теоретический расчет весов ионных состояний весьма сложен даже в простейших случаях. Поэтому представляется интересным определение степени ионности из каких-либо
617
свойств молекулы с тем, чтобы можно было предсказать другие свойства.
Наиболее удобно связать место молекулы в ряду гомео-гетерополярная связь с ее дипольным моментом μ. Экспериментальные методы измерения дипольного момента будут изложены в гл. XXV.
Введем величину эффективного заряда атомов X (в доле от заряда электрона). Тогда μ = Xed, где d - межатомное расстояние.
Молекула полностью гомеополярная, если μ, и, следовательно, X равны нулю. Чистой гетерополярной молекуле (например, NaF) отвечает равенство X единице.
Полинг приближенно предложил считать величину X за "процент ионности" молекулы. Так, например, для HCl X = 0,17 и, следовательно, по Полингу, эта молекула кислоты на 17 % гетерополярна и на 83 % гомеополярна. Такое предположение необосновано и потому, что квантово-химическая суперпозиция не означает простого наложения, и потому, что между свойством (в данном случае дипольным моментом) и структурой нет столь простой связи. Кроме того, само предположение о суперпозции двух типов структур снова является лишь приближенным описанием реального электронного облака молекул.
Лондон предложил в качестве критерия ионности молекул рассматривать соотношение между истинным расстоянием и кривой потенциальной энергии для чисто гетерополярной молекулы. На рис. XXIII.4 изображены два возможных случая.
На рис. XXIII.4, a кривая I, описывающая энергию ионного состояния, лежит выше кривой II, описывающей энергию гомеополярного состояния.
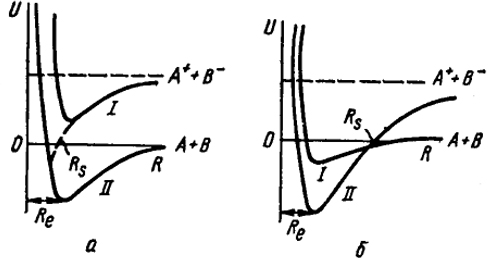
Рис. XXIII.4. Энергия атомной (
а) в ионной (
б) молекул (энергия диссоциации в основной состоянии)
618
На рис. XXIII.4, б - обратное соотношение. Очевидно, что в случае а степень ионности в молекуле будет мала, а в случае б - велика.
Правая ветвь ионной потенциальной кривой, как это следует из уравнения (XXIII.1), описывается уравнением
U = V - A - (e2/R).
(XXIII. 18)
Мы видим, что эта гиперболическая ветвь потенциальной кривой пересекает ось абсцисс в случае а левее межатомного расстояния, а в случае б правее. Абсцисса, пересеченная Rs, определяется из условия U = 0, откуда
Rs = e2(V - R).
Сравнивая Rs с межатомным расстоянием Re, можно определить положение молекулы в ряду гомео-гетерополярных молекул.
Действительно, например, для молекулы KCl Rs (0,27нм) значительно превышает Re/0,28 нм, в то время как для HCl они близки (Rs = 0,140 нм; Re = 0,128 нм).
619
