Явление катализа широко распространено в природе и интенсивно используется в технике для ускорения химических превращений. Катализатором называют вещество, которое существенно изменяет скорость реакции, оставаясь химически неизменным после ее окончания и не входит в состав продуктов превращения. Это, однако, не означает, что катализатор вообще не принимает участия в реакции. Влияние катализатора определяется его влиянием на протекание элементарных химических актов, при которых образуются неустойчивые промежуточные вещества. Это приводит к изменению механизма реакции, и она протекает по другому пути, чем в отсутствие катализатора. В результате уменьшается энергия активации реакции и увеличивается ее скорость. Вследствие распада промежуточных продуктов происходит регенерация катализатора, который вновь способен образовывать промежуточные соединения и, таким образом, продолжается его действие. Примером каталитической реакции является один из вариантов превращения молекул озона в кислород, происходящего в верхних слоях земной атмосферы:
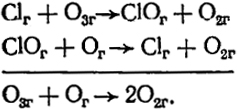
Здесь атомы хлора являются катализатором. Важно, что значительные изменения скоростей химических реакций наблюдаются при добавлении очень малых количеств катализатора по сравнению с массой реагирующих веществ.
Если катализатор ускоряет реакцию, то катализ называется положительным, а если замедляет - отрицательным. Вещества, уменьшающие скорость реакции, называют ингибиторами. Различают гомогенный и гетерогенный катализ. В первом случае, как в приведенном выше примере, катализатор и реагирующие вещества находятся в одной фазе - в газе или в растворе. Во втором - химическое превращение происходит на поверхности твердого тела, чаще всего на самом твердом катализаторе. Наиболее
520
важное практическое значение имеет гетерогенный катализ. В химической промышленности доля каталитических процессов составляет ∼70 %.
В металлургии катализаторы применяют в процессах, в которых участвуют газы, например, при получении защитных атмосфер в печах для термической обработки сплавов или при конверсии природного газа.
Для катализаторов характерна специфичность, т.е. способность ускорять лишь определенные реакции из числа потенциально возможных. Такие металлы, как медь и особенно никель, имеют большое сродство к водороду, который активированно адсорбируется на их поверхности. Подобные переходные металлы являются специфическими катализаторами для реакций дегидрогенизации. Так, при пропускании паров этилового спирта над Cu или Ni при 300-400° C происходит отщепление водорода и образование уксусного альдегида:
C2H5(OH)г → CH3CHOг + Hг.
Глинозем и некоторые другие оксидные катализаторы при обработке, обеспечивающей большую внутреннюю поверхность, активно адсорбируют пары воды и являются хорошими катализаторами реакции дегидратации. В присутствии глинозема приведенная выше реакция разложения спирта идет по другому пути, т.е. с образованием этилена и паров воды:
C2H5(OH)г → С2H4г + H2Oг.
Следует, однако, подчеркнуть, что катализаторы могут ускорять только термодинамически возможные реакции. Присутствие катализатора не может изменить состояние равновесия данной реакции, а лишь изменяет скорость, с которой достигается такое состояние. Это является следствием второго закона термодинамики, так как равновесию отвечает минимум энергии Гиббса. Для того, чтобы сместить равновесие при постоянной температуре, необходимо затратить работу. Очевидно, что само по себе присутствие катализатора не может служить источником такой работы. Поэтому с помощью катализатора нельзя изменить величину константы равновесия реакции по сравнению со случаем, когда та же реакция протекает по некаталитическому пути. При равновесии скорости прямой и обратной реакции равны между собой и, следовательно, -катализатор ускоряет обе эти реакции в одинаковой степени.
521
