Глубокая конверсия мономеров при полимеризации
Описанные выше закономерности реакции свободнорадикальной полимеризации правомочны для степеней конверсии мономеров лишь не более 10% при условии отсутствия фазовых превращений в реакционной среде.
При более глубоких степенях превращения мономеров в полимер необходимо учитывать существенно изменяющиеся физико-химические условия реакционной среды. В процессе синтеза часто наблюдается при больших конверсиях мономеров аномальное [по сравнению с предсказываемой уравнениями (5.3) и (5.4)] возрастание скорости полимеризации - явление, получившее название "гель-эффекта", "эффекта Тромодорфа".
231
Если полимеризовать метилметакрилат, предварительно растворив в нем полиметилметакрилат, то самоускорение синтеза наблюдается в самом начале полимеризации.
Гель-эффект не связан с саморазогревом реакционной смеси, несмотря на то что реакция полимеризации экзотермична, а определяется вязкостью реакционной среды. Рост вязкости среды качественно меняет динамику протекания процессов в реакционной среде.
Повышение вязкости приводит к усилению "эффекта клетки", что снижает эффективность инициатора. Диффузионный механизм выхода из "клетки" подавляется, а роль радикал-акцепторного механизма не возрастает, а тоже падает, потому что концентрация мономера (основного акцептора свободных радикалов) снижается. Так, например, при увеличении вязкости в результате полимеризации стирола в бензоле с 0,360 до 1,030 Па · с эффективность инициатора fэ 2,2'-азо-бис-изобутиронитрила снижается с 0,413 до 0,288. Значения fэ пероксида бензоила при полимеризации стирола в тетрахлориде углерода при возрастании вязкости среды в этих же пределах изменяются еще больше - с 0,82 до 0,36.
Эффективность инициатора fэ в процессе полимеризации можно вычислить по следующей формуле:

где [I]0, [М]0 - начальные концентрации инициатора и мономера соответственно, моль/дм3; Рn - среднечисленная степень полимеризации; Хм - степень превращения мономера.
Отношение [М]0Хм/Рп соответствует количеству образовавшихся материальных цепей. Произведение [I][1 - exp(-Kdt)] отвечает количеству образовавшихся радикалов.
Изменение вязкости среды приводит к изменению порядка реакции по инициатору. Так, для винилацетата при степени превращения Хм = 0,15 ÷ 0,25 порядок реакции п уменьшается с 0,5 до 0,3, а затем снова увеличивается и при степени конверсии более 40% становится равным единице.
Очень существенно отражается увеличение вязкости реакционной среды на процессах роста макрорадикалов и их обрыва. Например, при полимеризации бутилметакрилата увеличение степени превращения Хм до 70% приводит к уменьшению константы роста Кр с 2,93 · 10-3 в начале реакции до 0,044 · 10-3 дм3/(моль · с) и еще более значительному уменьшению константы обрыва Кo - с 4,8 · 10-8 до 0,0073 · 10-8 дм3/(моль · с).
232
Зависимость Кр и Кo от вязкости среды иллюстрируется следующими эмпирическими уравнениями:
константа скорости роста цепи Кр для винилацетата связана с вязкостью соотношением

а обрыва -

где Kp, Кo, η0 - соответственно константы реакций роста и обрыва цепи и эффективная вязкость реакционной смеси при Хм = 5%; К, К, η’ - соответственно константы скорости реакций роста и обрыва цепи и эффективная вязкость при Хм - 60%.
Сопоставление этих уравнений показывает, что, во-первых, с увеличением вязкости значения Kp и Кo уменьшаются, а во вторых, Кo значительно более чувствительна к величине эффективной вязкости среды, чем Кр. Отношение K
/
Ko с увеличением степени превращения растет, а следовательно, растет и скорость реакции полимеризации. Значения
Kр начинают существенно изменяться при
Хм > 0,5. Очевидно, что увеличение вязкости приводит к замедлению диффузионных процессов. В реакции роста макрорадикала принимают участие и макро-, и микрочастицы, т.е. макрорадикал и молекула мономера. Вместе с тем обрыв цепи происходит легче всего за счет рекомбинации двух макрорадикалов. Поэтому
Кр должна уменьшаться значительно медленнее, чем
Кo, а вместе с тем их отношение должно расти, и, следовательно, должна возрастать скорость полимеризации в целом, что и наблюдается как гель-эффект. Диффузионные ограничения с ростом вязкости для малых молекул возрастают в значительно меньшей мере, чем для громоздких макрорадикалов. Кроме того, макрорадикалы по мере увеличения степени полимеризации, находясь в растворенном состоянии, будут стремиться занять термодинамически наиболее выгодную конформацию статистического клубка.
Такой клубок моделируется эллипсоидом вращения с полуосями b/а (см. гл. 2). Собственно полимерная молекула (макрорадикал) занимает лишь около 3% объема клубка. Остальная часть его занята реакционной средой.
Увеличение степени полимеризации Рп макрорадикала приводит к увеличению размеров статистического клубка и в результате - к возрастанию вязкости раствора [см. уравнения (2.42) и (2.43)]. Это приводит к усилению "эффекта клетки", что проявляется в замедлении процессов диффузии макрорадикалов.
233
При малых степенях конверсии (Хм < 0,1) порядок реакции обрыва цепи п ≈ 2, а при Хм > 0,6 он уменьшается до 1,5 - 1,6, т.е. доля рекомбинаций радикалов уменьшается.
Однако увеличение вязкости среды на 4 - 5 десятичных порядков приводит к снижению Ko в 10 - 100 раз. В связи с этим гель-эффект может быть объяснен не только изменением вязкости среды, но и конформацией макромолекулярных радикалов, их равновесной гибкостью (см. гл. 2).
Кинетика полимеризации при глубоких степенях превращения обусловлена изменением не только Кo, но и Kd, Кр, Vi, [M*].
Задача. Полимеризация метилметакрилата в блоке производится в промышленном реакторе в присутствии пероксида бензоила. Подъем температуры в реакторе до 95°С происходит со скоростью 1 град/мин. После этого реакция проводится в изотермическом режиме. Концентрация инициатора составляет 0,1 моль/дм3.
Рассчитайте концентрацию мономера в реакционной смеси на момент достижения изотермического режима, если известно, что К = 0,705 · 103 дм3/(моль · с), ΔEр = 19,7 кДж/моль (см. табл. 5.3). К = 2,55 · 107 дм3/(моль с), ΔE0 = 5,02 кДж/моль; К = 4,7 · 10-5 дм3/(моль с), ΔEd = 124,32 кДж/моль; коэффициент эффективности инициатора fэ = 0,7.
Решение. Скорость инициирования, учитывая высокую энергию активации разложения инициатора, будет зависеть главным образом от концентрации радикалов в реакционной смеси, а их количество определяется температурой:
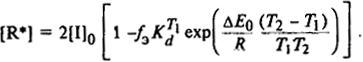
Скорость инициирования может быть рассчитана по уравнению
Vi = Ki[M][R*]
Концентрация мономера на момент начала реакции будет составлять
[М]0 = ρ/М0 = 936/100 = 9,36 моль/дм3,
где ρ - плотность метилметакрилата, кг/м3.
Скорость реакции полимеризации метилметакрилата может быть описана уравнением
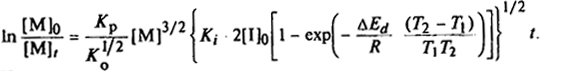
Кроме процессов инициирования и распада инициатора следует учесть и температурное изменение констант роста и обрыва цепи.
Для расчета констант скорости реакций по известной величине константы скорости и энергии активации процесса можно воспользоваться уравнениями

234
Учитывая, что скорость подъема температуры составляет 1 град/мин, в результате расчета по приведенным выше уравнениям получаем
ln[М]95 = 1,3693 и, соответственно, [М] = 3,93 моль/дм3.
Поэтому превращение мономера за время разогрева реактора составит
100 = 57,99 ≈ 58%.
235
