2.4.2. Коллигативные свойства реальных растворов полимеров
В реальных растворах взаимодействие между молекулами растворителя и полимера приводит к изменению равновесной гибкости полимерных цепей и, как результат, к изменению числа кинетически независимых сегментов макромолекул. Увеличение концентрации растворенного полимера обусловливает также возрастание вероятности столкновений сегментов соседних молекул, что соответствует интенсификации межмолекулярных взаимодействий в системе и характеризуется изменением химического потенциала Δμ1 [см. уравнение (1.23)].
Как было отмечено ранее, уравнение (1.25) графически изображается прямой с тангенсом угла наклона tgα = RT/Мп · В (см. рис. 1.7).
Значения второго вириального коэффициента В обусловливаются величиной Мn, разветвленностью и полидисперсностью полимера, гибкостью макромолекул. Иными словами, коэффициент В может служить мерой отклонения осмотических свойств реального раствора от идеального в результате "разбухания" молекулярных клубков. Этот процесс, обусловленный осмосом растворителя в молекулярный клубок, предполагает изменение конформаций макромолекул, переход их в новые энергетические состояния. Разница между обоими равновесными энергетическими уровнями соответствует работе упругих сил, стремящихся вернуть молекулу в первоначальное состояние. Разбухание клубков прекращается, когда осмотические силы уравновешиваются упругими.
106
Значение коэффициента В зависит от разветвленности макромолекул. Увеличение разветвленности при Мn = const приводит к уменьшению второго вириального коэффициента. Отношение т = Вл/Вр, где Вл и Вр - вторые вириальные коэффициенты линейного и разветвленного полимеров с одинаковой молекулярной массой соответственно, в данном растворителе может служить мерой разветвленности.
Вопрос. При изучении зависимости осмотического давления πo от концентрации растворов двух образцов полиэтилена низкой плотности в декалине при 120°С было установлено, что в обоих случаях значение [πo] = 1,93. Однако высота подъема растворов конечной концентрации в капилляре осмометра для одного из образцов больше. Объясните возможную причину этого явления.
Ответ. Возможной причиной различного подъема растворов в капиллярах может быть различие в полидисперсности и степени разветвленности сравниваемых образцов полиэтилена.
Значение В является также мерой сродства между растворителем и полимером. Растворение полимера - самопроизвольный процесс, сопровождающийся уменьшением химических потенциалов. Поэтому коллигативные характеристики, в том числе и осмотическое давление πo, являются мерой интенсивности взаимодействия между полимером и растворителем. В хорошем растворителе значения В велики. При растворении полимера в плохом растворителе происходит минимальное изменение коллигативных свойств.
Растворитель, в котором В = 0, соответствует θ-растворителю.
Для θ-растворителя зависимость πo/С = f(С) выражается прямой 2 (см. рис. 1.7).
Ранее отмечалось, что расчетные размеры молекулярных клубков меньше реальных. Это связано с фактическими ограничениями свободы конформационных переходов потенциальным барьером U0. Дополнительные ограничения в изменении формы макромолекул возникают в результате взаимодействия полимера с растворителем.
Если [h]1/2 характеризует размеры молекулярного клубка, обусловленные скелетной гибкостью, а [h2]1/2 - аналогичная характеристика для реальной макромолекулы в данном растворителе, то их отношение ζ служит мерой разбухания молекулярного клубка в данном растворителе. Коэффициент ζ показывает, во сколько раз изменяются размеры макромолекулы в результате внутримолекулярных взаимодействий соседних сольватированных сегментов.
107
Чем выше сродство растворителя к полимеру, тем больше ограничений возникает для свободного вращения звеньев макромолекулы относительно друг друга, тем сильнее разбухание молекулярного клубка:

где [h]1/2 и [h2]1/2 - размеры молекулярного клубка в тэта- и данном растворителе соответственно.
В θ-растворителе отсутствуют объемные эффекты, связанные с взаимным отталкиванием звеньев: при этом образуется невозмущенный клубок.
Коэффициент разбухания ζ зависит от температуры Т. При Т = θ ζ = 1. Это справедливо для всех волокнообразующих полимеров. Зависимость этой характеристики от молекулярной массы для достаточно длинных полимерных цепей следующая ζ = M
.
Разбухание молекулярных клубков в растворителе обусловливается изменением свободной энергии конформационных переходов и описывается уравнением Флори

Здесь ψ1 - параметр, характеризующий энтропию смешения сегментов полимерной цепи с молекулами растворителя. Величина Сm определяется из соотношения

где NА - число Авогадро; vn - объемная доля полимера; vр - мольный объем растворителя.
Изменение химического потенциала, обусловленного взаимодействием сегментов и растворителя, становится при этом равным нулю [см. уравнение (2.28)].
В θ-условиях изменение конформации макромолекул определяется только скелетной гибкостью полимерных цепей.
Мерой равновесной гибкости макромолекул в растворе может служить величина статистического сегмента, оцениваемая по результатам осмометрических измерений. Для раствора конечной концентрации справедлива формула πo = RTC/Mc, где Mс - молекулярная масса сегмента. 108
108
Таблица 2.4. Значение второго вириального коэффициента В для некоторых систем полимер - растворитель
| Полимер |
Растворитель |
Температура,°С |
Mn · 10-4 |
B · 102, дм3/(г2·моль) |
| Поливинилхлорид |
Циклогексанон |
48 |
7 |
29,7 |
| Поливинилацетат |
Ацетон |
30 |
20 |
6,0 |
| Полиакрилонитрил |
Диметилформамид |
25 |
5,2 |
19,0 |
| Полистирол |
Бензол |
20 |
15 |
2,73 |
| Полиэтиленоксид |
Вода |
25 |
7 |
1,01 |
| Вторичный ацетат целлюлозы (γ = 240) |
Тетрахлорэтилен |
25 |
5,9 |
2,4 |
| Триацетат целлюлозы |
Диметилсульфоксид |
25 |
9 |
12,6 |
| Карбоксиметилцеллюлоза (γ = 70) |
Вода |
25 |
7,5 |
0,29 |
| Нитрат целлюлозы (γ = 210) |
Ацетон |
20 |
8 |
4,3 |
Вопрос. При изучении осмотических свойств растворов одного и того же образца полистирола в различных растворителях в изотермических условиях были найдены следующие значения В [100 см3 (г2·моль)-1]:
| Толуол |
3,12·10-2 |
| Дихлорэтан |
2,88·10-2 |
| Циклогексан |
-0,24·10-2 |
Объясните возможную причину таких различий в значениях второго вириального коэффициента.
Ответ. Различия в значениях коэффициента В объясняются различным термодинамическим сродством растворителя к полимеру (качеством растворителя).
С увеличением молекулярной массы полимера величина коэффициента В уменьшается во многих случаях в соответствии с уравнением

где C1 и β - постоянные.
Например, для системы полиакрилонитрил - диметилформамид при 25°С C1 = 2,43·10-2, а β = 0,22. Значения коэффициента В для растворов некоторых волокнообразующих полимеров приведены в табл. 2.4.
Задача. Вычислить второй вириальный коэффициент В для раствора поли-α-метилстирола в толуоле при 25°С (из данных задачи на с. 30).
Решение. Из графика зависимости πo/С = f(C) находим
tgα = 2·10-2/3·10-4 = 66;
так как tgα = RTB/Mn, то В = 2,7·10-2 дм3/(г2·моль).
109
Изменение химического потенциала растворителя при разбавлении раствора описывается уравнением

где V1 - мольный объем раствора; ρ1 - плотность растворителя; M0 - молекулярная масса растворителя; ρп - плотность полимера; χ1 - параметр взаимодействия, характерный для данной системы полимер - растворитель (параметр взаимодействия Флори).
Сопоставляя уравнения (1.23) и (2.37), легко видеть, что коэффициент В связан с χ1 следующим соотношением:

Задача. Вычислить значение параметра взаимодействия χ1 для растворов карбоксиметилцеллюлозы в 0,5M водном растворе NaCl, если при 25°С В = 1,45·10-2 дм3/(г2·моль); ρп = 1,502 г/см3; ρ1 = 1,020 г/см3.
Решение. Значение M для раствора соли принимаем равным аддитивной мольной сумме компонент. Тогда согласно формуле (2.38) имеем
χ1 = 0,5 - В ρ M0/(ρ1RT) = 0,49 ≈ 0,5.
Второй вириальный коэффициент В может быть экспериментально оценен из данных осмотического давления πo при двух концентрациях:

Задача. Вычислить значение В для растворов полиэтилентерефталата с Рп = 120 в гексафторизопропаноле при 25°С, если раствор полимера, имеющий концентрацию С1 = 1,0 г·дм-3, характеризуется π = 0,7·10-2 атм, а С2 = 3,5 г·дм-3 - значением π = 2,7·10-2 атм.
Решение. Величина Мn = 120·192 ≈ 23·103.
Согласно формуле (2.39) имеем
B = = 4,27 · 10-3.
Второй вириальный коэффициент В связан с молекулярными параметрами цепей, а также ζ [см. уравнение (2.33)] следующим соотношением:
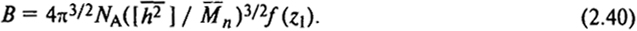
Здесь nA - число Авогадро; f (z1) - убывающая функция z, где z1 - параметр исключенного объема.
110
Для z1 << 1 имеем f(z1) = 1 - 2,865z1 - 9,202z
... .
При z1 = 0 значение f(z1) = 1.
Принимая во внимание величину разбухания молекулярного клубка [см. уравнение (2.34)], можно показать, что
ζ5 - ζ3 = = l,276z1.
111
